第6篇 电极反应理论(1): Butler-Volmer 方程的推导
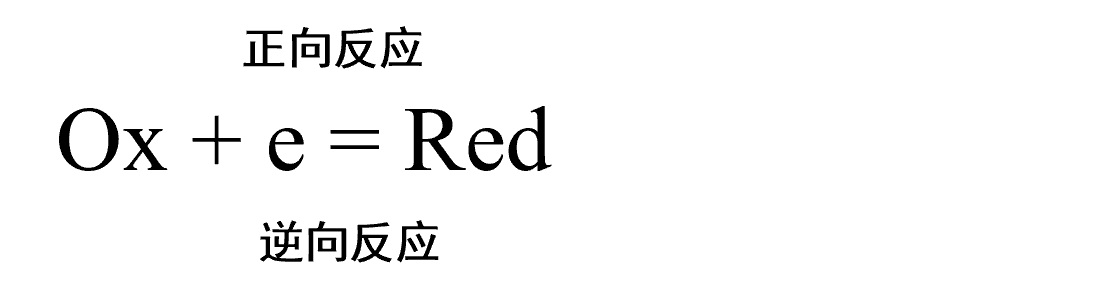
在上述反应情况下,假设在电极的表面氧化剂的浓度为COx,频率因子为 A,则上述反应的正向反应速率 vf可以用式26表示。
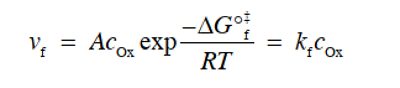
当电位差Δφ存在于电极-电解质溶液界面时,从电极到溶液中氧化物Ox的电子转移会受其影响。
在图7(c)中,假设电势梯度可以线性逼近,从反应坐标的起始状态侧看,能量曲线的峰值在划分为α:1-α的位置。 此时,需要额外的活化能αFΔφ才能从初始状态到达能量曲线的顶部。 因此,此时的反应速率 vf 可以通过将式(26)中的 ΔG°‡f 改成ΔG‡f 来重新排列得到式28
在图7(c)中,假设电势梯度可以线性逼近,从反应坐标的起始状态侧看,能量曲线的峰值在划分为α:1-α的位置。 此时,需要额外的活化能αFΔφ才能从初始状态到达能量曲线的顶部。 因此,此时的反应速率 vf 可以通过将式(26)中的 ΔG°‡f 改成ΔG‡f 来重新排列得到式28
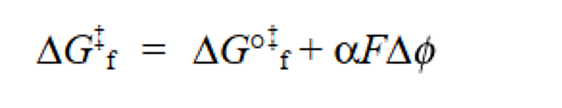
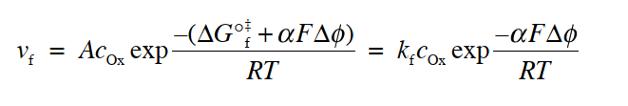
反应速度vf是单位时间内每单位面积发生反应的氧化态物质Ox的物质量,所以如果将每摩尔的电量F乘以vf,即为单位面积的还原电流(阴极电流, cathodic), 即, 阴极电流密度可改写为ic(下标“c”表示阴极)的式29,
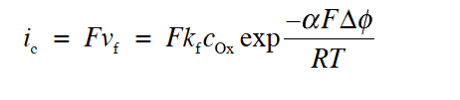
因此,在电化学中,必须始终牢记与电极反应相关的电流(也称为法拉第法拉第电流)对应于反应速度。
根据类似的论点,逆向的反应速率 vb 和阳极电流密度 ia可以表示为式30
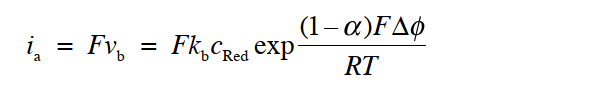
假设反应在电极表面上达到平衡状态。 即正向和反向的反应速度相等(vf=vb),换句话说,就是阳极电流密度和阴极电流密度相等(ic=ia),通过界面的净电流密度为零。且电位差 Δφ 用平衡电位差 Δφeq 表示,enter↓ 将此时的电流密度用 i0 (ic=ia)来表示,则可以得到式31。
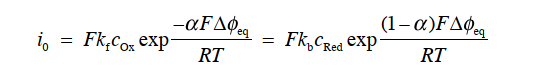
这里 i0 称为交换电流密度,从它是 kf 或 kb 的函数可以看出,它是一个反映电极反应动力学特性的指标。 i0 会发生多个数量级的变化,这不仅取决于反应类型(即氧化还原与 Ox / Red 的类型)和温度,还取决于电极材料及其表面状态。
当有净电流流过电极电解质界面的情况下,当然此时的 ic不等于 ia。 按照惯例,将阳极电流为正,阴极电流为负,则净电流密度 i 可以用式32表示。
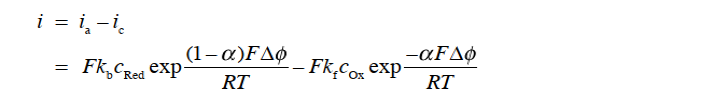
其中 Δφ 是非平衡时电极-电解质界面上的电位差。 式(32)简单说明了电极反应的电流相对于两点之间的电位差(M ΔSφ)呈指数变化即,与欧姆定律的线性关系不同。这是因为该等式包括电位差Δφ,这是一个无法实际测量的值。 我们只能测量电位差Δφ的变化和差异。 因此,我们将这个Δφ分成平衡电位差Δφeq 及其变化量η(=Δφ-Δφeq )来进行考虑。
这种变化量称为过电位(over potential),其可以使用参比电极进行测量 式(33)。
这种变化量称为过电位(over potential),其可以使用参比电极进行测量 式(33)。
这里,Eeq是使用参比电极测量的氧化还原对 Ox / Red 的平衡电极电位。 将从式 (33)中得到的Δφ = Δφeq+ η 的关系式,代入式 (32) 并利用式 (31) 的关系,得到式34。
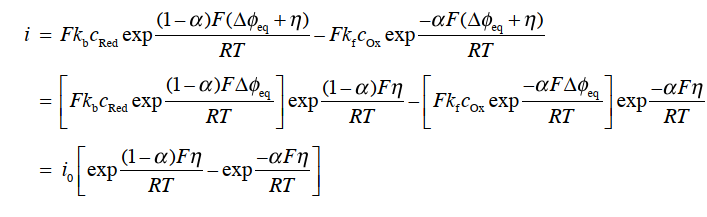
该方程(34)是描述净电流密度(即净电极反应速度)是如何随着,与平衡电位的偏差 η(过电位)而变化的基本方程,称为 Butler-Volmer 方程。
