第三篇 电极反应动力学(3):标准速度常数
考虑一个非常特殊的情况,例如 CR = CO = 1 (mol dm-3)(浓度标准的标准状态),反应处于平衡状态。(因为在平衡时表面浓度和本体浓度是相等的)。 此时的方程(4)和(5)的反应速率可以表示为式15,式16.
当反应达平衡状态时 ,正向与逆向反应速度相等(式17), 可以得到式(18), 因为它处于平衡状态,且速度相等,如果我们将其表示为式(19), 这个 k0 是标准速率常数(standard rate constant)
k0 标准速率常数(standard rate constant)
由于平衡电位 Eeq 等于式量电位 E0, 式(9)可表示为式(20)
将式(19), 式(20)代入式(13) 得到氧化反应速度常数:Kox的表示变形为式(21)。同样如果代入式(14)也一样,可得到还原反应速度常数 Kred
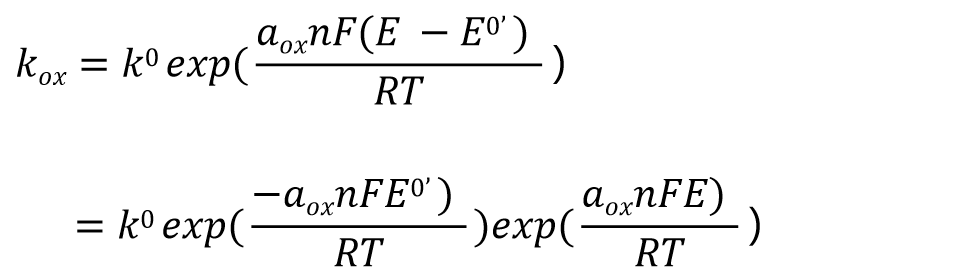
这是以E0’ 作为电位的标准的速率常数表达式。
将上述方程的式21 与用于一般平衡电位的式(13)进行比较,那么Kox表示为式22, 并进一步变化成式23,进一步得到式24.
将上述方程的式21 与用于一般平衡电位的式(13)进行比较,那么Kox表示为式22, 并进一步变化成式23,进一步得到式24.
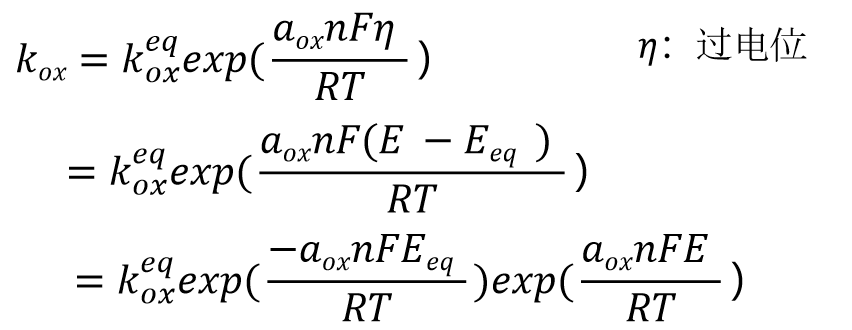
(22)
将氧化或还原反应的平衡电位处的反应速度常数Keq分别对外加过电位进行作图后可以得到反应速度常数与电位依存关系图3。
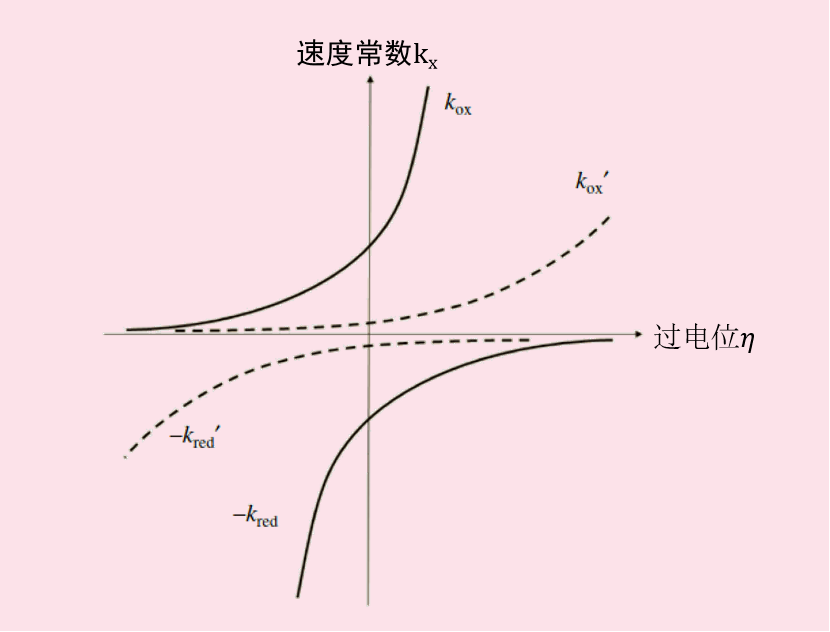
图 3. 反应速度常数与电位依存关系。
图中实线代表平衡电位处的反应速度常数Keq较大情况下的,氧化或还原反应的反应速度常数与电位的依存关系。
虚线的曲线代表Keq较小情况下的,氧化或还原反应的反应速度常数与电位的依存关系。
Keq系数的大小是由反应的类型和条件的不同性质的电子转移反应速率决定。 在Keq较大的反应中,通过对电极施加轻微的过电位(极性较小),反应速度会发生显著变化,而在Keq较小的反应中,除非外加较大的过电位,否则反应将无法进行。
