第一篇. 电极组成的类型
(1) 金属-金属离子电极 M | Mn+
金属-金属离子电极, 就是将金属丝(板)浸入含有同类金属离子的溶液中构成的电极(图1)。
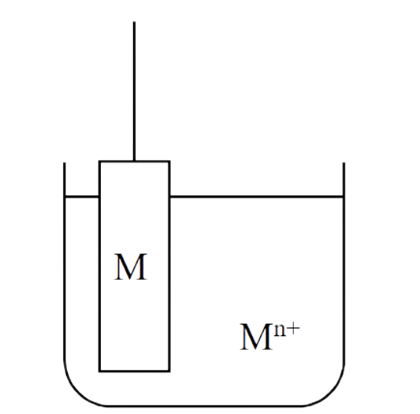
举个最简单的例子,就是把银线浸入银离子的溶液(比如硝酸银溶液)电极反应式为银离子得到一个电子还原成银原子(式1)。
电极电位的Nernst方程可以用式2表示,电极电位和银离子浓度有关。
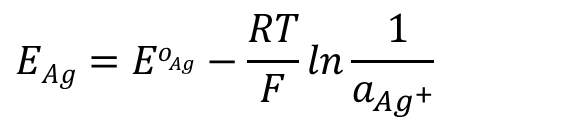
另一个大家熟悉的电极,就是将金属锌棒浸入硫酸锌溶液中,形成的金属锌与2价锌离子的电极。
电极反应可以表示为,一个2价锌离子得到2个电子,还原生成锌原子(式3)。
电极反应可以表示为,一个2价锌离子得到2个电子,还原生成锌原子(式3)。
该电极反应的Nernst方程可以表示为式4.
从上述各式可以看到,这类金属-金属离子电极的电位会随溶液中金属离子的活度的变化而变化。
(2) 金属-难溶金属盐电极 M | MX | Xn-
下面介绍第二类电极就是金属-及其难溶盐电极。
这类电极中的代表,就是我们非常熟悉的银氯化银电极。
(2) 金属-难溶金属盐电极 M | MX | Xn-
下面介绍第二类电极就是金属-及其难溶盐电极。
这类电极中的代表,就是我们非常熟悉的银氯化银电极。
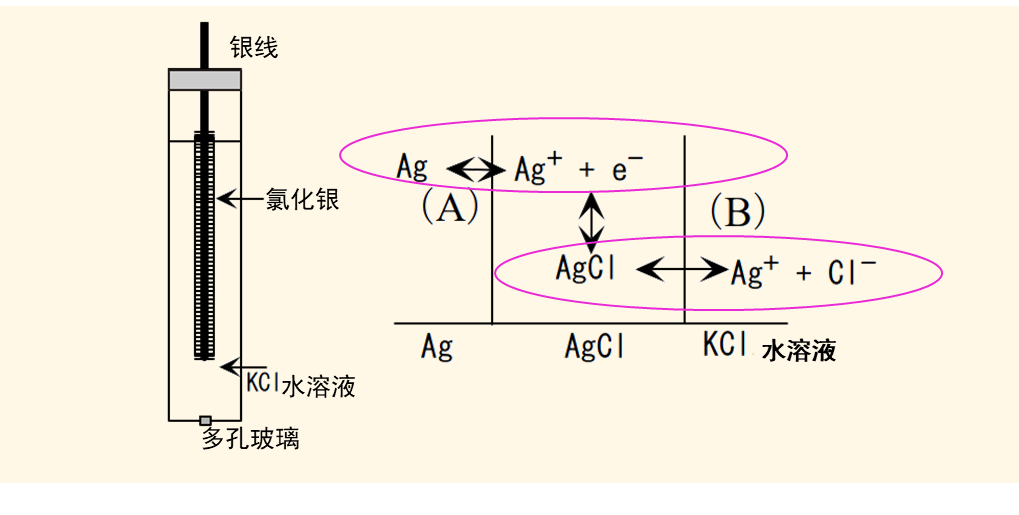
图2 Ag | AgCl 电极的构造示意图
Ag | AgCl 电极的构造如图2所示。一般是在银线上覆盖氯化银沉淀,然后浸入装有氯化钾或氯化钠溶液的玻璃管中,玻璃管的前端使用多孔玻璃或陶瓷作为液接部的材料,可以让离子可以自由出入。根据电极书写规则,电极可以这样书写:Ag | AgCl | Cl-
该电极反应式为AgCl固体得到1个电子生成银原子同时释放出一个氯离子。
该电极反应式为AgCl固体得到1个电子生成银原子同时释放出一个氯离子。
其Nernst方程式在6式中表示。这类电极的电极电位与形成沉淀的阴离子氯离子的浓度相关,电极反应包含了图2中的这些反应过程。如果增加溶液中阴离子氯离子的浓度,就可以有效抑制AgCl的溶解反应的进行,从而保持溶液中溶解的银离子的活度保持在一个恒定的值。
当上述这些反应达到平衡时,银·银离子电极的电位与银氯化银电极的电位应该相等。EAgCl =EAg, 从式(6),式(2)得到下下述关系式7。
当上述这些反应达到平衡时,银·银离子电极的电位与银氯化银电极的电位应该相等。EAgCl =EAg, 从式(6),式(2)得到下下述关系式7。
将式7进行移项变化后得到式8a,进一步将方程式中的对数项进行合并后得到8b。
根据标准电极电位数据表中记载的银银离子电极,以及银氯化银电极的标准电极电位数值EoAg = 0.7991 V,EoAgCl = 0.2222 V , 代入8b式后,计算得到银离子活度与氯离子的活度积为→ 𝑎Ag+ ・ 𝑎Cl- = 1.667×10-10 。也就是AgCl的溶度积常数为KSP =1.667×10-10 。
Ag-AgCl电极的电位是由Cl-活度大小决定。 如果Cl-的活度保持不变时(饱和溶液),电位也保持不变。 由于这类金属及其难溶盐电极,在含有其高浓度阴离子的溶液中的电位十分稳定,因而可以代替SHE作为常规的参比电极(reference electrode)使用。
(3) 氧化还原电极 Pt | Mm+, M(m-n) +
氧化还原电极通常是将铂金电极浸入金属m+价和金属(m-n)+价离子的溶液中构成的电极(图3)。
Ag-AgCl电极的电位是由Cl-活度大小决定。 如果Cl-的活度保持不变时(饱和溶液),电位也保持不变。 由于这类金属及其难溶盐电极,在含有其高浓度阴离子的溶液中的电位十分稳定,因而可以代替SHE作为常规的参比电极(reference electrode)使用。
(3) 氧化还原电极 Pt | Mm+, M(m-n) +
氧化还原电极通常是将铂金电极浸入金属m+价和金属(m-n)+价离子的溶液中构成的电极(图3)。
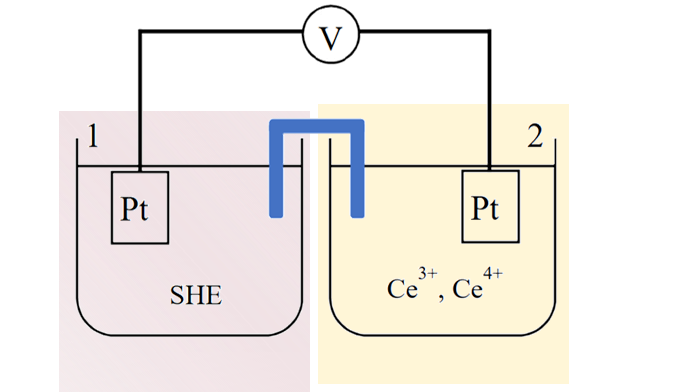
图3 Pt | Ce4+, Ce3+电极
电极反应可用式9表示, Nernst方程式可用式10表示
比如将铂金电极浸入含3价和4价柿离子的溶液中构成的氧化还原电极(式11),电极反应为Ce4+得到一个电子,还原成Ce3+。
Nernst方程式为式12, 此类电极电位取决于溶液中氧化态和还原态离子的活度比。
还有作为决定电极电位的参考标准的氢电极,也属于此类氧化还原电极: Pt(s) |H2(g) | H+ (aq)。
与上面的Ce4+ /Ce3+氧化还原电极不同的是,氢气为气相,而氢离子在液相中,书写电极时两者之间应加入一根短竖线表示存在着的相界面。
氢电极的反应式和Nernst方程式表示如下。
