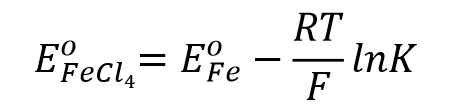第七篇式量电位(formal potential)
在热力学标准状态下,活度 αH+= 1 ([H+] = 1 mol dm-3, pH = 0) 是电位的参考标准。在生物化学中, 通常把pH = 7 作为标准。
a) 电位随溶液pH值而变化的体系
在此以氢电极(式43)为例。
对于上述的电极反应,其Nernst方程可以写成式44
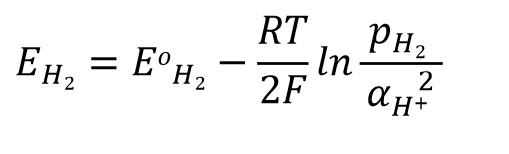
假设H+ 离子的活度系数为1,氢气的分压为1 个大气压,此时电位与氢离子浓度间的关系可表示为式45.
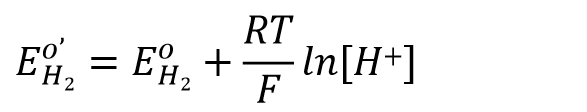
在此EO'H22 为式量电位(也就是说在恒定的pH值下,电极的电位为恒定值),
在1个大气压下的溶液的电极电位与与pH的关系可以表示为式46.
对于生物化学体系,pH7.0时的氢电极的式量电位为-0.414V
b)配合物形成的体系
再来看一下络合物形成的体系。比如对于这样一个,3价铁离子的4氯合铁配离子得到一个电子还原成二价铁离子并放出4个氯离子的还原反应(式47)
b)配合物形成的体系
再来看一下络合物形成的体系。比如对于这样一个,3价铁离子的4氯合铁配离子得到一个电子还原成二价铁离子并放出4个氯离子的还原反应(式47)
上述反应的Nernst方程可表示为式48, 将氯离子浓度相关部分取出后(式49),将其与标准电极电位部分进行合并后,
其式量电位可以表示成式50. 也就是说,如果配体的浓度恒定时,电极电位亦恒定。
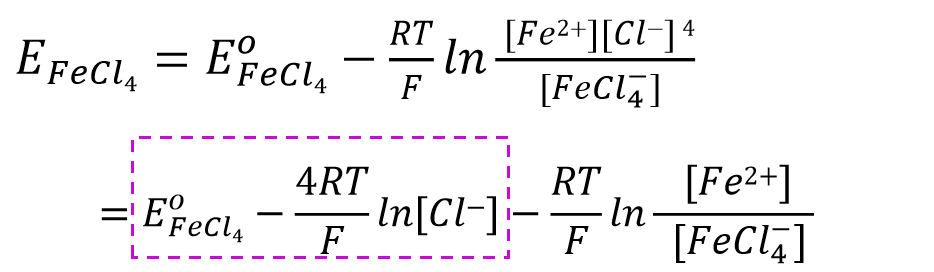
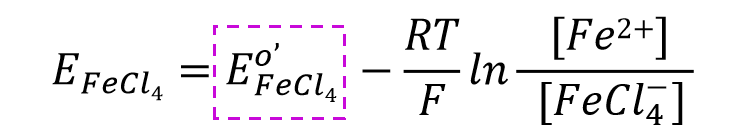

对于配合物形成的体系,配体氯离子的浓度增加,式量电位会向负方向移动,说明配位反应使得氧化态更稳定 。
比如3价铁离子与氯离子形成4氯合铁配离子的反应(式51), 配合物生成反应平衡常数可表示为式52
比如3价铁离子与氯离子形成4氯合铁配离子的反应(式51), 配合物生成反应平衡常数可表示为式52
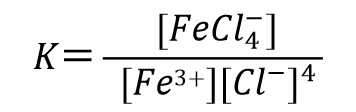
对于式53这样一个电极反应, 电极电位可表示为式54
式(48)可变形为式55。
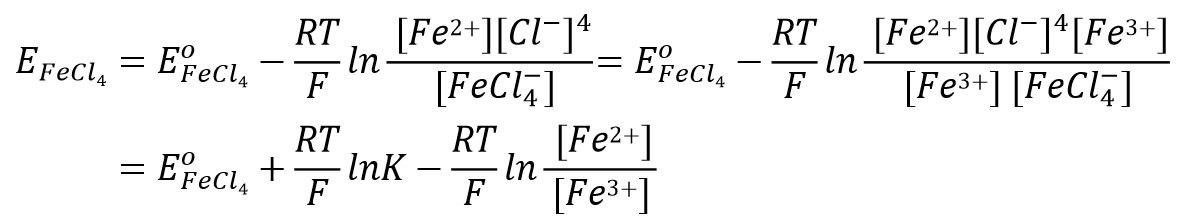
达到平衡时,配合物的标准电极电位可以用式56表示。