第十三篇 支持电解质的影响效果
由于支持电解质的阳离子和阴离子会与极性相反的物质或产物发生反应,从而会对电极反应产生各种影响。
1) 当金属离子与电解质盐的阴离子形成离子对或配合物时,金属离子的还原电位会变得更负。
2) 金属离子在给体性越强的溶剂中,电解质盐的阳离子半径越大,金属离子就越容易还原 (还原电位变得更正)
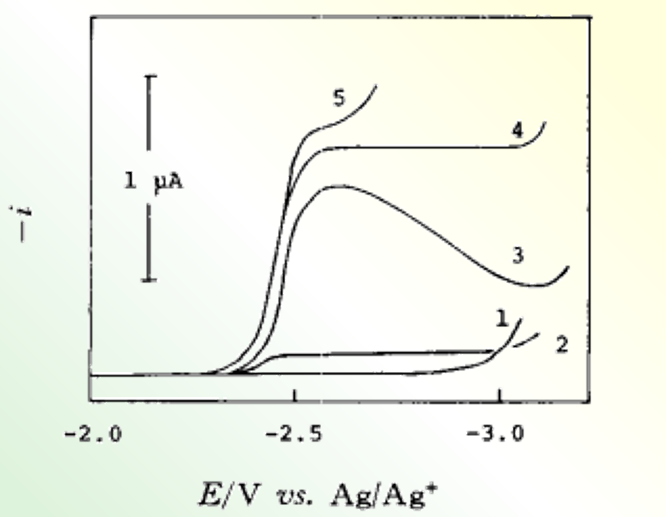
图8 支持电解质的阳离子对HMPA中Na+还原波的影响
1,Me4N+,Et4 N+ ; 2, Bu4N+ ; 3, Hex4N+ ; 4,Hep4N+ ;5,Li+(各0.05 M ClO4-盐)。 Na+浓度为0.5 mM。
当支持电解质阳离子为四甲基铵根,或四乙基铵根离子时,钠离子完全不能被还原,只能看到残余电流;当支持的电解质阳离子为四丁基铵根离子时,得到一个非常小的还原波,这个波有着与反应电流相同的特征。
当电解质阳离子的半径进一步变大时,比如锂离子、四庚基铵根离子等情况下,Na+离子的还原波形接近于可逆的扩散控速波形。
这种现象可以定性地解释如下:
在负电位下,半径小的阳离子优先被吸引靠近电极表面,而较大的阳离子则因为较小的阳离子的存在而无法接近表面。当电解质阳离子稍稍变大时,如四丁基铵根离子,这种影响会变小,一些Na+在靠近电极表面的地方被还原(通过渗透或脱溶剂化作用)。 当阳离子进一步变大时,几乎没有干扰效应,得到了扩散控速还原波。
由此可见,支持电解质的阳离子在负电位下对金属离子还原的影响在给体性(碱性)最强HMPA中非常显著,在给体性强的DMSO、DMA,DMF等溶剂中,碱金属和碱土金属离子的还原反应中普遍见到的现象。
但在弱给体性溶剂,如乙腈(AN)或 碳酸丙烯脂(PC) 中,这种现象则不太明显。
3) 支持电解质的阳离子对有机化合物还原的影响
当电解质阳离子的半径进一步变大时,比如锂离子、四庚基铵根离子等情况下,Na+离子的还原波形接近于可逆的扩散控速波形。
这种现象可以定性地解释如下:
在负电位下,半径小的阳离子优先被吸引靠近电极表面,而较大的阳离子则因为较小的阳离子的存在而无法接近表面。当电解质阳离子稍稍变大时,如四丁基铵根离子,这种影响会变小,一些Na+在靠近电极表面的地方被还原(通过渗透或脱溶剂化作用)。 当阳离子进一步变大时,几乎没有干扰效应,得到了扩散控速还原波。
由此可见,支持电解质的阳离子在负电位下对金属离子还原的影响在给体性(碱性)最强HMPA中非常显著,在给体性强的DMSO、DMA,DMF等溶剂中,碱金属和碱土金属离子的还原反应中普遍见到的现象。
但在弱给体性溶剂,如乙腈(AN)或 碳酸丙烯脂(PC) 中,这种现象则不太明显。
3) 支持电解质的阳离子对有机化合物还原的影响
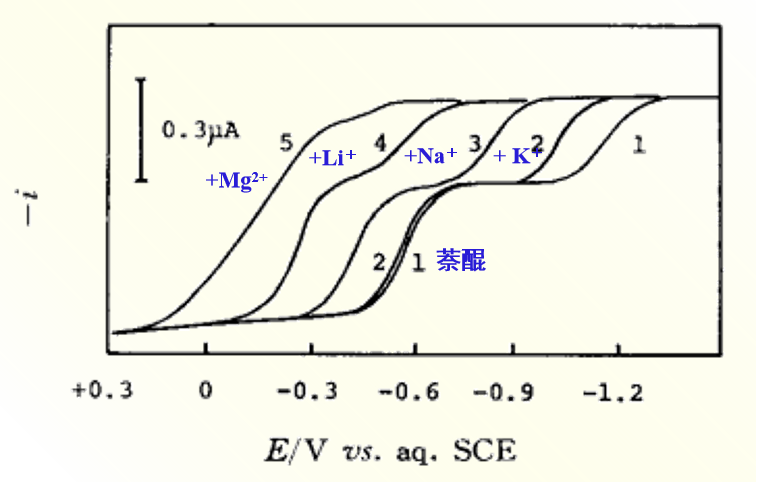
图9 在 乙腈溶剂中金属离子对1,2-萘醌还原波還元波的影响
(1):0.05 M Et4NClO4,0.5 mM 萘醌,(2):(1)十5 mM K+ ,(3):(1)十5 mM Na+ ,(4):(1)十 5 mM Li+,(5): (1)十5mM Mg2+
在非质子性溶剂中,有机化合物还原反应的第一步还原产物的阴离子自由基,具有容易与各种金属离子形成离子对的性质,因此可以使用金属盐作为支持电解质,或者可以在测极谱图时在 4烷基铵盐溶液中添加金属离子,如图9所示,第一个还原波向正电位移动(从这个半波电位的正向移动,可以求得离子对生成常数)。
可以发现,金属离子半径变得越小,或者电荷数越多,或者是象乙腈AN、或碳酸丙烯脂(PC) 那样给体性越小的溶剂中,越容易发生半波电位的正向移动。
可以发现,金属离子半径变得越小,或者电荷数越多,或者是象乙腈AN、或碳酸丙烯脂(PC) 那样给体性越小的溶剂中,越容易发生半波电位的正向移动。
我们知道这种离子对的形成促进了R∸阴离子自由基(R∸)的歧化反应和聚合反应。 因此,钠离子盐和锂离子盐不适合作为测量有机化合物还原反应的支持电解质。
在阴离子自由基进一步得到一个电子生成2价烷基阴离子的第二步的反应,会比第一步反应更容易受到支持电解质阳离子的影响。当有碱金属离子存在时,还原电位明显变正,究其原因,可以认为是 因为2价烷基阴离子比阴离子自由基更容易与支持电解质阳离子形成离子对。相反,当4烷基铵根离子的半径增加时,还原电位逐渐向负电位方向移动,究其原因似乎应该考虑由于双电层结构变化带来的影响。
参考文献
[17] K.Izutsu,S.Sakura and and T.Fujinaga,Bull. Chem. Soc..Japan 45,445(1972); 46,493,2148(1973).
[18] T. Fujinaga,K. Izutsu and T.Nomura,J. Electroanal. Chem. 29, 203 (1971)
