第十篇 电化学测量的电位范围(上)
可用于电极反应测量的电位范围(在溶解了支持电解质的溶液中,可获得残余电流的电位范围) 在很大程度上取决于组成电解液的溶剂和支持电解质、以及用于测量的电极类型及其表面状况。下面,以汞电极和铂电极为例,先讨论负电位方向的电位极限。
对于汞电极 : 由于汞电极上氢的过电位大,酸性溶剂除外,通常支持电解质的阳离子会在溶剂之前被还原。由于四烷基铵离子可以还原为汞齐 R4N (Hg) n而稳定存在,所以适合作为还原反应的支持电解质。 这种汞齐在非质子性溶剂如乙腈和二甲基甲酰胺等中可以相对稳定地作为电极表面的薄膜存在,但它在水溶液中立即与水反应。由于碱金属离子可以与汞形成稳定的金属汞齐。可在高于四烷基铵离子0.5 至 1 V 的正电位处发生还原。在汞电极中,即使含有杂质水分子,负电位极限也不会有太大变化。
对于铂电极: 在质子性溶剂中,如在水存在的情况下,负电位的极限为水还原产生氢气的电位。 但在非质子性溶剂中,支持性电解质中的阳离子的还原往往会成为负电位极限。 碱金属离子的还原电位会因其溶解度的强弱而出现很大的变化,可能比四烷基铵阳离子的还原电位更正或更负。碱金属离子在许多非质子性溶剂中被还原,沉积在电极上,但当Na+、Li+等,在强供体性HMPA中作为支持电解质的阳离子时,从电极表面产生的蓝色溶出电子进入溶液,成为负电位方向的极限。

注: 括号中显示的是电流密度为10 µA/mm2时的支持性电解质种类。
1)HClO4 2) LiClO4 3) NaClO4 4) Et4NClO4 5) Bu4NC1O4 6) Hep4NC1O4 7) Et4NBF4 8) KPF6
表8的蓝色背景部分,为铂电极在各种溶剂中的可测负电位的极限。可以看到在许多情况下,铂电极的负电位范围比汞电极的更宽。
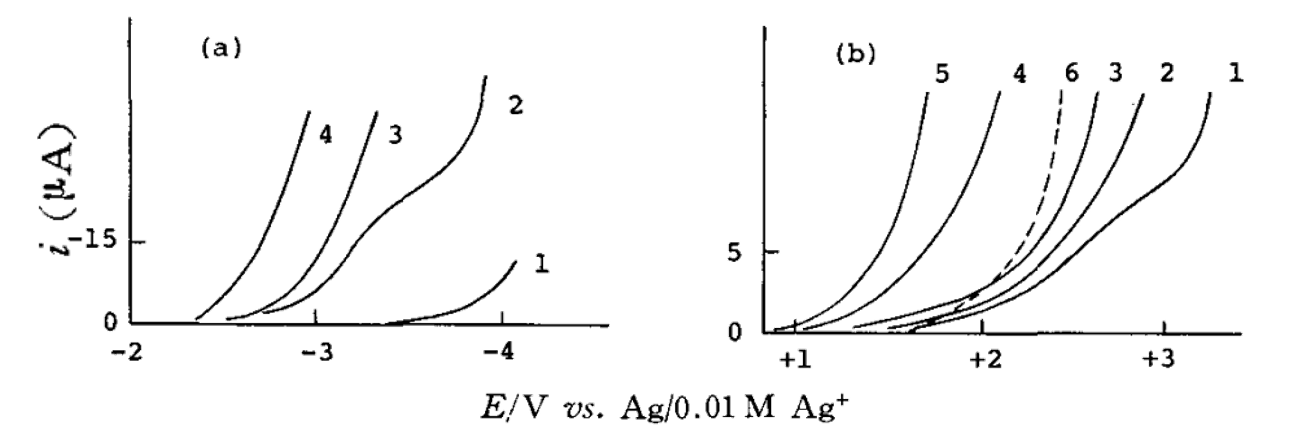
图7 水含量对PC溶剂中铂金电极上残余电流的影响[12]
(a) 0.1M Bu4 NClO4 中的负电位方向。 水的浓度: 1, ~0M; 2, 0.01 M; 3, 0.03 M; 4, 0.1 M
(b) 在0.1M KPF6中的正电位方向。 水的浓度:1, 0.01M; 2, 0.03 M; 3, 0.1 M; 4, 0.5 M; 5, 1 M (6 是在0.1M LiClO4中,水浓度为 0.001 M)
参考文献
[1] A.J.Bard, ed.,“Electroanalytical Chemistry”,VoL8, D.Bauer and M Breant,Solute behavior in solvents and melts,a study by use of transfer activity coefficients,p.281(1975),Marcel Dekker.
[12 ] J. Courtot-Coupez and M.L’Her,Bull.Soc.Chim. Fr.1970,1631)
