第七篇 有机溶剂中的酸碱平衡和pH值范围(上)
HA 型酸在溶剂中解离的反应可以分为如式 (8) 所示的两个步骤:
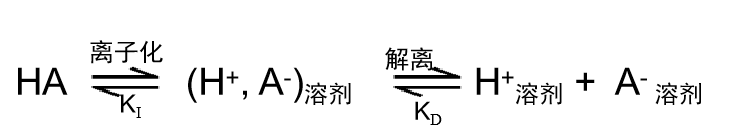
由此,为了使Ka变大,KI和KD都需要变大。也就是说酸 HA 的离子化过程和(离子对)的解离这两个过程必须都要容易发生。
在电离过程中,溶剂按
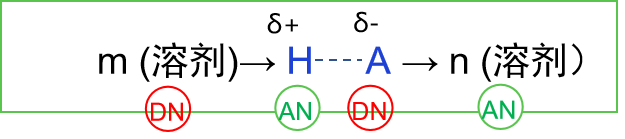
此外, 从前面提到的Fuoss公式 (3) 中可以看出,溶剂的相对介电常数越大以及 H+和 A-离子之间的最近距离越大, 溶剂化离子对 (H+, A- )的解离会越容易。
对于HA型酸, 除了解离反应,还可以发生这样的同质共轭反应,同质共轭反应常数KfHA2- 的值在表6中的括弧内表示。
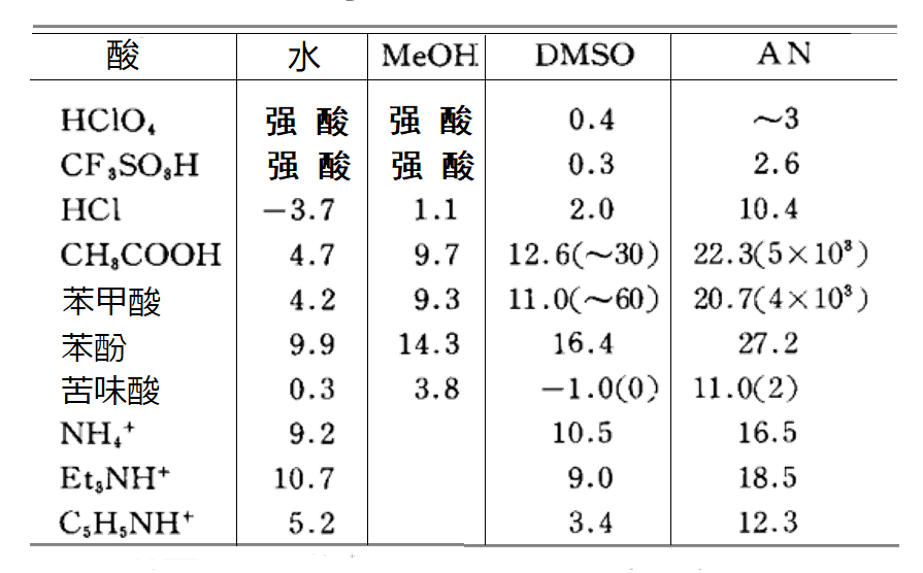
水的给体性和受体性比较强,且相对介电常数大,是一种容易使酸发生解离的溶剂。
另一方面,给体性和受体性均比较弱的乙腈溶剂中,H+ 难于发生溶剂化,还有A- 离子的溶剂化作用往往也难以发生。因此酸的 pKa很大,几乎没有可以完全解离的酸。然而,在具有强供体性质的DMSO中,H+ 被强溶剂化,因此pKa比在乙腈中的小,并且相对容易溶剂化阴离子的苦味酸等酸可以完全离解。
表6显示了BH+型酸的BH+ ⇔ B + H+ 的解离 pKa,这种类型的酸的解离受BH+ 、B、H+的溶剂化作用强度的影响,其中H+ 的溶剂化作用的影响相对较大。因此,乙腈(AN)中的pKa要比DMSO中的pKa大得多。DMSO中的pKa通常与水溶液中的pKa大致相同。
参考文献:
[10] I. M. Kolthoff and P. J. Elving ed.,“Treatise on Analytical Chemistry,”2nd ed. Part I,Volume 2 (1979).
