第六篇 影响离子溶剂化的因素(下)
(c) 水分子间能形成氢键的结构,所以其熵值低。
水分子间能形成氢键的结构,所以其熵值低。当亲水性离子(很多无机离子是亲水性的)进入水中时,由于水分子和离子间的相互作用很强,会使离子周围的水的整体结构被破坏,使其之熵增大。
但是,当四烷基铵离子(R4N+)和四苯基硼酸根离子(Ph4B-)等疏水性大离子进入水中时,与离子疏远的周围水分子会进一步结合增加了它们的氢键结构(结构形成),使其之熵降低。
结果,这些疏水性大离子在水中变得不稳定,而在无氢键结构的有机溶剂中,则可以更稳定地存在(见表 5)。
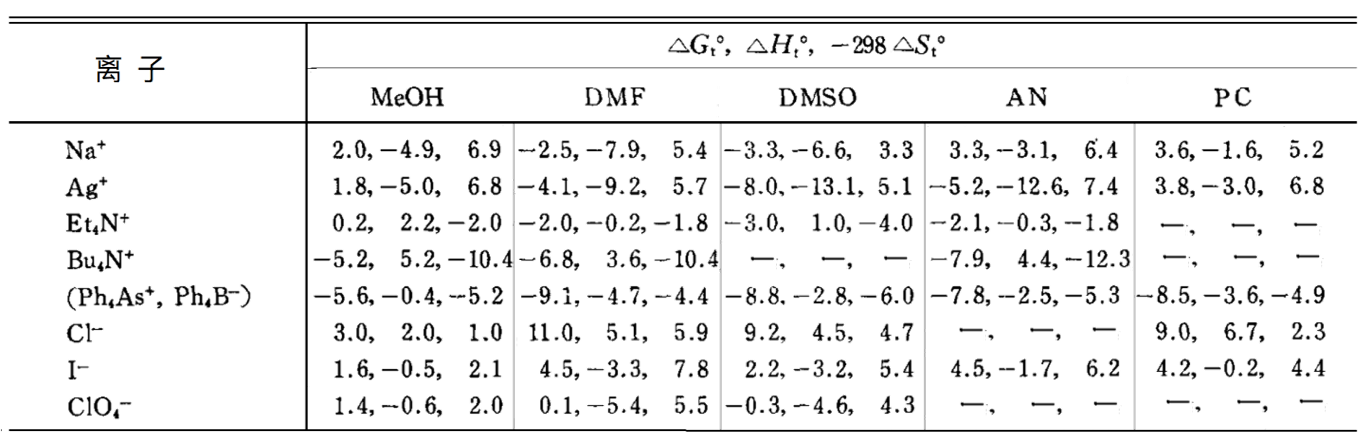 基于外热力学假设。△Gt0(Ph4As+)=△Gt0(Ph4B+),△Ht0(Ph4As+)=△Ht0(Ph4B+),△St0(Ph4As+)=△St0(Ph4B+)的关系成立。单位为kcal mol-1.
基于外热力学假设。△Gt0(Ph4As+)=△Gt0(Ph4B+),△Ht0(Ph4As+)=△Ht0(Ph4B+),△St0(Ph4As+)=△St0(Ph4B+)的关系成立。单位为kcal mol-1.
几乎不溶于水的四丁基高氯酸铵盐和 四己基高氯酸铵盐能很好地溶解于有机溶剂中用作支持电解质,就是因为这个原因。
(D) 当考虑路易斯的酸碱相互作用时,有必要区分酸和碱的“硬”和“软”性质。
也就是说,硬酸与硬碱,软酸与软碱之间容易产生相互作用。 即使在金属离子的溶剂化中,这种效果也可能很明显。
(D) 当考虑路易斯的酸碱相互作用时,有必要区分酸和碱的“硬”和“软”性质。
也就是说,硬酸与硬碱,软酸与软碱之间容易产生相互作用。 即使在金属离子的溶剂化中,这种效果也可能很明显。
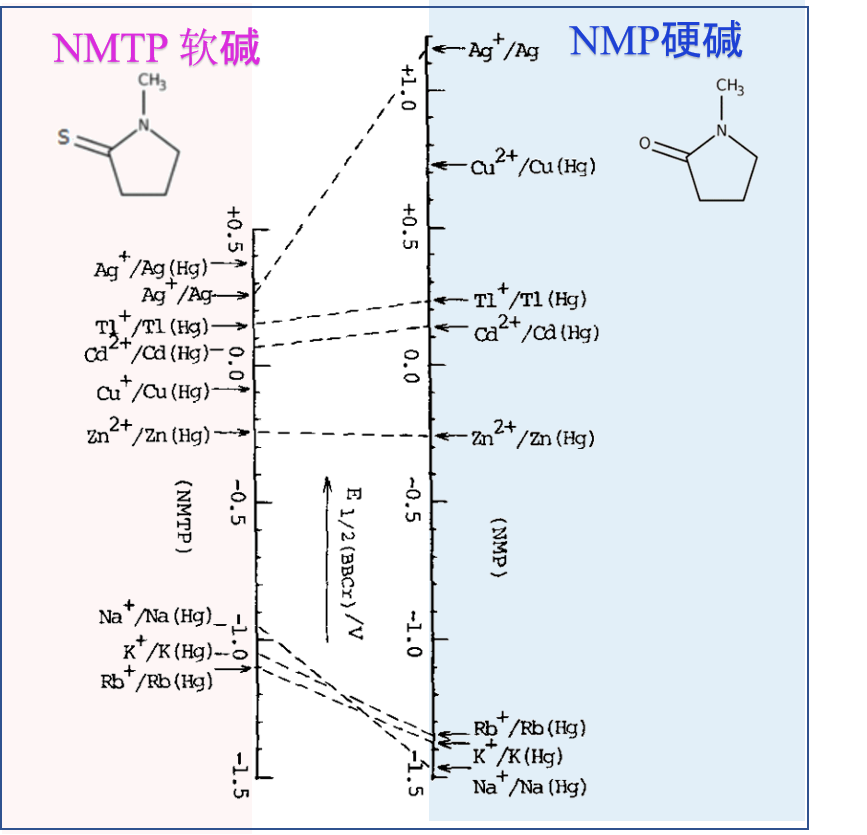 图4 N-甲基吡咯烷酮 (NMP) 和 N-甲基硫代吡咯烷酮 (NMTP) 中的金属离子半波电位比较 (vs. E1/2 of bisphenyl chromium (I) )
图4 N-甲基吡咯烷酮 (NMP) 和 N-甲基硫代吡咯烷酮 (NMTP) 中的金属离子半波电位比较 (vs. E1/2 of bisphenyl chromium (I) )
例如图4显示了硬碱N-甲基吡咯烷酮(NMP,其氧原子与金属离子配位)和软碱N-甲基硫代吡咯烷酮(NMTP,其S原子与金属离子配位)配位中的金属离子的半波电位。由于这些半波电位是基于双联苯铬 (I) 配合物的半波电位(被认为是无论在何种溶剂中,都可以显示出几乎恒定的值),因此金属离子在两种溶剂中的溶剂化作用 为硬酸 Na+、K +等在硬碱 NMP 中的溶剂化作用强,而软酸 Cu+、Ag+ 等在软碱性 NMTP 溶剂中的溶剂化程度更高。在二甲基甲酰胺DMF和二甲基硫代甲酰胺DMTF中也观察到了类似的现象。
(e) 乙腈 (AN) 的 给体数DN 值相对较小,因此在乙腈中金属离子的溶剂化作用一般较弱。
然而,一价的金属离子如Ag+和Cu+在乙腈 (AN) 溶剂中则不同,具有非常强的溶剂化作用和稳定性。 (比较表5中乙腈 和丙烯碳PC中的Ag+ΔGt0)。 这是因为d 电子从金属离子回馈给腈基。 因此,银离子和一价铜离子在乙腈溶剂中不易被还原为金属。
(e) 乙腈 (AN) 的 给体数DN 值相对较小,因此在乙腈中金属离子的溶剂化作用一般较弱。
然而,一价的金属离子如Ag+和Cu+在乙腈 (AN) 溶剂中则不同,具有非常强的溶剂化作用和稳定性。 (比较表5中乙腈 和丙烯碳PC中的Ag+ΔGt0)。 这是因为d 电子从金属离子回馈给腈基。 因此,银离子和一价铜离子在乙腈溶剂中不易被还原为金属。
