第二篇 溶剂相对介电常数的影响(1)
离子的溶剂化能与离子-溶剂相互作用的若干要素相关,其中静电溶剂化能ΔGel可以由以下Born公式表示[1]。
式(1)中,ze为离子的电荷; r 为半径; N为阿伏伽德罗常数; εr为相对介电常数。假设这个方程中 r 是常数,随着 εr的减小ΔGel 的绝对值便会减小。但在εr大于20 范围内的 ΔGel 绝对值的减小比较平缓,但会在εr小于10的范围内呈现急速减少。由于静电溶剂化能ΔGel 占据了离子总溶剂化能的大部分,相对介电常数(特别是εr<5)较小的溶剂因其静电溶剂化能ΔGel 绝对值变小,溶剂对离子的溶剂化作用一般较弱。
此外,溶液中的阳离子和阴离子可以各自以能使溶液导电的解离状态存在, 亦可如式(2)所示那样发生结合,以离子对的形式而存在。
假设溶剂化阳离子和溶剂化阴离子之间的缔合反应的常数为Kass,logKass大致可以用下面的Fuoss近似公式(3)表示。
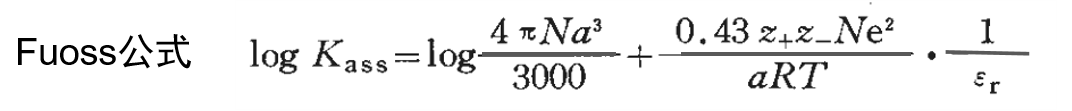
式中,z+e 和 z-e 是 M+ 和 X-的电荷,α 是M+ 和 X- 离子之间的最近距离 。
从式(3)可知,logKass与αεr的倒数几乎呈线性关系,可以预测如果相对介电常数εr越小,或离子之间的最近距离α越小,越容易形成离子对,其溶液的导电性降低.
下面来看一下α值较大的四丁基苦味酸铵的log Kass 和 εr倒数之间的关系,可以看到两者之间存在着较好线性关系。
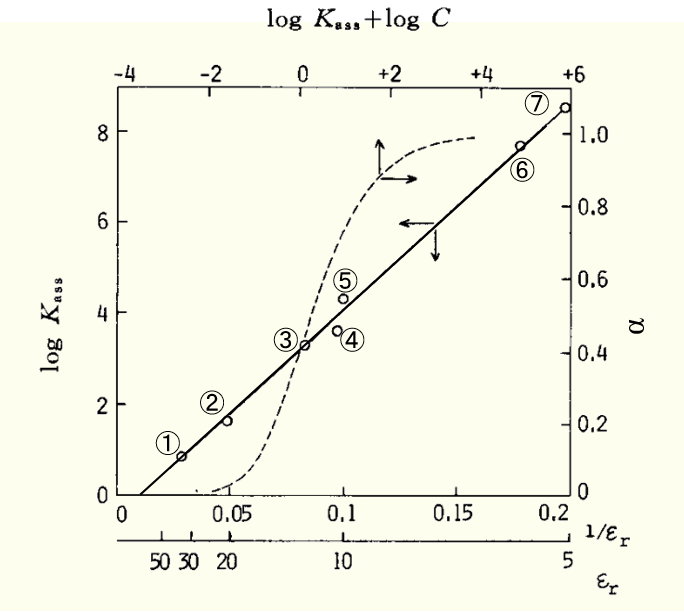
図1 Bu4NPic(四丁基苦味酸铵)的缔合常数与溶剂的相对介电常数εr的关系
溶剂:① C6H5NO2 , ② Ac, ③ Py, ④ CH2ClCH2Cl, ⑤ CH3CHCl2 , ➅ C6H5Cl, ⑦m-C6H4Cl2
(Y. H.Inami et al.,J. Phys.Chem.83,4745(1961).
虚线是缔合度 α 与 log(C Kass )(C: Bu4NPic 的摩尔浓度mol dm-3)之间的关系。
假设溶液中的 四丁基铵根阳离子和 苦味酸根阴离子的分析浓度为C M(M=mol d-3),则M+与X-的缔合度α与log(C Kass ) 之间存在如图1 中虚线所示的关系。例如,对于 0.01M 四丁基苦味酸铵,可以看出,当所用溶剂的 εr>30 时,80% 以上发生解离,而当溶剂的εr<10 时,90% 以上以离子对的形式存在。
参考文献
[1] A. J.Bard,ed.,“Electroanalytical Chemistry”,Vol.3,C. K. Mann,Non-aqueous solvents for eiectro-chemical use,p.57(1969),Marcel Dekker.
参考文献
[1] A. J.Bard,ed.,“Electroanalytical Chemistry”,Vol.3,C. K. Mann,Non-aqueous solvents for eiectro-chemical use,p.57(1969),Marcel Dekker.
