应用例(4)多巴胺的高灵敏选择性检测
据介绍,IDA电极的宽度和间隙的小型化有望实现高度精确的测量,提高灵敏度并加快响应速度。 为了证明这些,描述了对多巴胺的调查结果,多巴胺是一种在体内以微量存在并发挥重要作用的儿茶酚胺10-1。
与二茂铁等典型的可逆物质相比,多巴胺的电子传递速度慢,而且不稳定(在高pH值下), 是一种可能由于电化学反应后的化学反应而会随时间变化的物质。因此,通过使用这种微电极,在G极产生的氧化还原物质可以在很短的时间内被C极捕获,从而有望能出现捕获和恢复不稳定中间物的显著效果。
图10-1显示了GC模式和O模式下多巴胺的CV测量值。在通常的测量方法 O 模式下,峰值波形不对称,但在 GC 模式下,观察到较大的限制电流,表明可以进行高灵敏度测量。
与二茂铁等典型的可逆物质相比,多巴胺的电子传递速度慢,而且不稳定(在高pH值下), 是一种可能由于电化学反应后的化学反应而会随时间变化的物质。因此,通过使用这种微电极,在G极产生的氧化还原物质可以在很短的时间内被C极捕获,从而有望能出现捕获和恢复不稳定中间物的显著效果。
图10-1显示了GC模式和O模式下多巴胺的CV测量值。在通常的测量方法 O 模式下,峰值波形不对称,但在 GC 模式下,观察到较大的限制电流,表明可以进行高灵敏度测量。
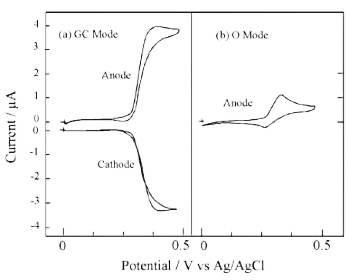
图 10-1. IDA电极上的多巴胺 CV测量结果
图10-2显示了在多巴胺低浓度下的测量实例:在100nM时,即使在G极的阳极也能观察到可量化的曲线,在C极观察到清楚的极限电流,在这里充电电流没有噪音。
在10nM,一个数量级的低浓度下,在阳极一侧不能获得可定量化的曲线,但在阴极一侧可以进行定量的测量,尽管可以观察到由于剩余电流导致的基线斜率。 在很宽的浓度范围内观察到与氧化还原有关的极限电流,并观察到浓度和电流之间的良好线性关系(图18)。 这表明IDA电极对微量成分的定量检测是有效的。
在10nM,一个数量级的低浓度下,在阳极一侧不能获得可定量化的曲线,但在阴极一侧可以进行定量的测量,尽管可以观察到由于剩余电流导致的基线斜率。 在很宽的浓度范围内观察到与氧化还原有关的极限电流,并观察到浓度和电流之间的良好线性关系(图18)。 这表明IDA电极对微量成分的定量检测是有效的。
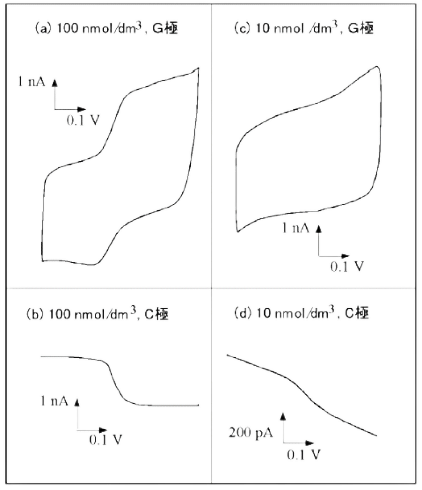
图10-2 低浓度多巴胺的伏安图
尽管已经证明在测量多巴胺时可以进行高灵敏度的检测,但在实际系统中,大量的L-抗坏血酸共存,干扰了测量。 在这样一个系统中的反应是复杂的:多巴胺首先被氧化,但立即被共存的抗坏血酸还原,所以无法用普通电极进行选择性检测。
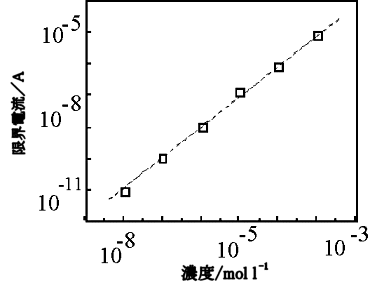
图 10-3 多巴胺极限电流的浓度依赖性图。
图10-4显示了使用两种不同尺寸的微叉指阵列电极的循环伏安图,单独的多巴胺和与抗坏血酸共存的情况相比较。对于相对较大的叉指电极(10 µm 电极宽度,5 µm 间隙),在单独使用多巴胺的情况下,在氧化侧和还原侧都观察到了极限电流(a)。而在含有多巴胺和六倍于此的抗坏血酸剂量的体系中,即使在还原侧也没有观察到明显的信号,噪声水平较小 在氧化方面,观察到一个由抗坏血酸介导的峰和一个抗坏血酸本身的氧化峰(b),使多巴胺的选择性检测成为不可能。 这意味着对于这里使用的大小电极来说,氧化物种在扩散到还原电极时被后续反应所改变。
另一方面,较小尺寸的电极(3µm 电极宽度,2µm 间隙),如图10-4右侧所示,即使在混合体系中也能观察到多巴胺的极限电流,这表明多巴胺的氧化物种在变化之前就在还原电极上被检测到(d)。 这种选择性明确地取决于电极的几何形状,并有望随着电极的变小而得到改善。 由于IDA电极本身的选择性和聚合物膜的改性,可以预期进一步的选择性检测。
另一方面,较小尺寸的电极(3µm 电极宽度,2µm 间隙),如图10-4右侧所示,即使在混合体系中也能观察到多巴胺的极限电流,这表明多巴胺的氧化物种在变化之前就在还原电极上被检测到(d)。 这种选择性明确地取决于电极的几何形状,并有望随着电极的变小而得到改善。 由于IDA电极本身的选择性和聚合物膜的改性,可以预期进一步的选择性检测。
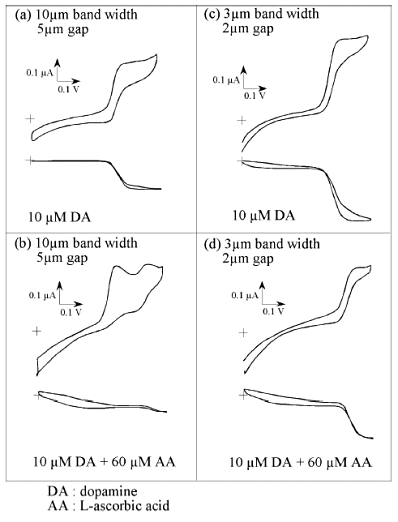
图10-4多巴胺和抗坏血酸的伏安图。
图20显示了用Nafion(上层)和聚酯离子膜(下层)双层膜修饰的梳状电极对多巴胺进行选择性检测的结果,Nafion具有很好的多巴胺选择性,而聚酯离子膜在膜内具有很高的多巴胺扩散性。23 在样品中,有浓度为多巴胺0到100倍的L-抗坏血酸。 L-抗坏血酸的浓度比多巴胺高0到100倍。
测量是通过在梳状电极的C电极上施加多巴胺的还原电位和在G电极上从0V到多巴胺的氧化电位进行的。 在样品中没有抗坏血酸的情况下,C电极上的电流在电位步骤后立即达到稳定状态,表明氧化的多巴胺在膜上迅速扩散。 另一方面,当电极被Nafion单层修饰时,由于多巴胺在膜中的低扩散率,快速反应没有实现,电流的绝对值下降。
其次,在含有过量抗坏血酸的样品中,C电极上的电流一开始很低,但几秒钟后就增加了,并与不含抗坏血酸的样品中得到的数值几乎相同。 在施加电位后,由于下层薄膜中存在L-抗坏血酸,大部分在G极氧化的多巴胺在到达C极之前就被还原了,而L-抗坏血酸的选择性很低。 然而,由于Nafion膜的原因,抗坏血酸每次只能从溶液中提供一点进入膜,所以膜中的浓度迅速下降。
测量是通过在梳状电极的C电极上施加多巴胺的还原电位和在G电极上从0V到多巴胺的氧化电位进行的。 在样品中没有抗坏血酸的情况下,C电极上的电流在电位步骤后立即达到稳定状态,表明氧化的多巴胺在膜上迅速扩散。 另一方面,当电极被Nafion单层修饰时,由于多巴胺在膜中的低扩散率,快速反应没有实现,电流的绝对值下降。
其次,在含有过量抗坏血酸的样品中,C电极上的电流一开始很低,但几秒钟后就增加了,并与不含抗坏血酸的样品中得到的数值几乎相同。 在施加电位后,由于下层薄膜中存在L-抗坏血酸,大部分在G极氧化的多巴胺在到达C极之前就被还原了,而L-抗坏血酸的选择性很低。 然而,由于Nafion膜的原因,抗坏血酸每次只能从溶液中提供一点进入膜,所以膜中的浓度迅速下降。
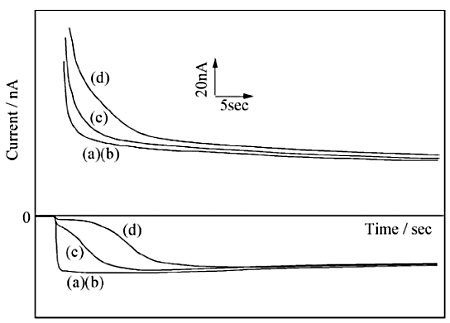
图 10-5 用亲水/聚酯离聚物双层膜修饰的梳状电极上的多巴胺选择性
多巴胺:10 µM,L-抗坏血酸,a:0 µM,b:200 µM,c:600 µM,d:1000 µM
参考文献
[10-1] O. Niwa, Y. Xu, H. B. Halsall and W. R. Heineman, Anal. Chem., 65, 1559 (1993).
[10-1] O. Niwa, Y. Xu, H. B. Halsall and W. R. Heineman, Anal. Chem., 65, 1559 (1993).
